Тема.
Кількість речовини. Моль – одиниця кількості речовини. Число Авогадро.
Мета:
- сформувати
поняття про кількість речовини, з`ясувати значення числа Авогадро;
сформувати вміння обчислювати число атомів і молекул за відомою кількістю
речовини й кількість речовини – за відомим числом молекул.
- розвивати
вміння логічно мислити, аналізувати та оцінювати об`єкти та явища.
- виховувати
вміння вести дискусію.
Обладнання: Періодична
система хімічних елементів.
Базові поняття
та терміни: атом, молекула, кількість речовини, моль, стала Авогадро.
Тип уроку: вивчення
нового матеріалу.
Методи
навчання: пояснювально-ілюстративні, репродуктивні, частково-пошукові, практичні.
Девіз уроку: Мудрість людей
вимірюється не їх досвідом, а їх здатністю набуття досвіду. Б.Шоу
ХІД УРОКУ
І.
ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ.
АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Фронтальна бесіда
1) Із чого
складаються всі речовини на Землі? (З атомів, молекул, йонів)
2) Наведіть приклади речовин молекулярної та немолекулярної будови. ( I2,
Cl2; NaCl, CaF2, алмаз)
3) В яких одиницях вимірюються розміри атомів? (нм, тобто 10−9
м, ra = 10−14 см, якщо атом збільшити до
розміру друкарської крапки, то пропорційно збільшена людина досягала б
зросту близько 7 км )
4) Якою є маса атома? (Це маленька частинка, реальна маса якої
оцінюється величиною порядку 10−27 −10−26 кг)
5) Скільки молекул води H2O міститься в краплі води? (Багато,
порядку 1023 молекул)
6) А скільки атомів Карбону міститься в діаманті вагою 1 карат?
(0,2г)
Розв’язати задачу нам допоможе величина, з якою ми
познайомимося на сьогоднішньому уроці.
Повідомлення
теми та мети уроку.
ІІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУРозповідь учителя.
Ще у ХVIII столітті для хімічних обчислень водночас із масою й об’ємом було
введено фізичну величину, яка дозволяла розрахувати кількість структурних
частинок (атомів, молекул, йонів) у певній порції речовини. Ця величина
одержала назву «кількість речовини».
Кількість
речовини - це фізична величина, що показує число структурних частинок (атомів,
молекул, йонів) у певній порції цієї речовини.
Позначається грецькою літерою ν (ню) (або n). Одиниця вимірювання кількості речовини - моль.
Назва одиниці вимірювання кількості речовини походить від латинського слова «moles», що в перекладі означає «кількість, безліч».
Відомий італійський учений Амедео Авогадро вивчив і виміряв кількість речовини для різних речовин. З допомогою спеціальних розрахунків А. Авогадро підрахував, що у 12 г вуглецю міститься 6,02·1023 атомів.
Таку кількість речовини взяли за 1 моль. Ця стала, на відміну від числа Авогадро, виражається в одиницях, ділених на моль (1/моль або моль 1).
Отже, 1 моль - це
кількість речовини, що містить стільки ж частинок (атомів, молекул, йонів),
скільки атомів міститься у 12 г
вуглецю, тобто 6,02·1023 частинок.
Для приблизних обчислень
число Авогадро округляють до 6∙1023.
Знаючи сталу Авогадро, можна будь-яку кількість речовини виразити в молях. Якщо речовина містить N молекул (або структурних одиниць), то кількість речовини дорівнює:
ν = N/ NA
Навпаки, знаючи кількість речовини в молях, можна знайти число частинок:
N = ν ∙NA
Запитання для дискусії.
– Як ви гадаєте, якщо ми візьмемо один моль двох
різних речовин, чи будуть це однакові кількості за зовнішнім виглядом?
( Ні. Об’єм ( або маса ), який буде займати 1 моль
речовини, буде залежати від об’єму (або маси), який займає молекула цієї
речовини. Оскільки в різних речовинах різні молекули, той об’єм і маса 1 моль речовини
будуть різні).
Вчитель демонструє різні речовини
кількістю в 1 моль.(цукру, меду, води, сірки).
Учні приходять до висновку:
Маса і об’єм 1 моль різних
речовин відрізняються.
IV. ЗАКРІПЛЕННЯ НОВОГО МАТЕРІАЛУ (КЕРОВАНА ПРАКТИКА)
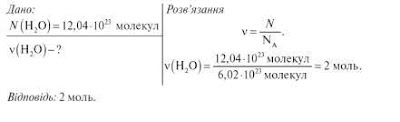
1. Обчисліть кількість речовини в порції води, що
містить 12,04∙1023 молекул.
2. Обчисліть число атомів Феруму в порції заліза кількістю речовини 5 моль.
V. ПІДБИТТЯ ПІДСУМКІВ
– Кількість речовини – це величина фізична, що визначається числом структурних
частинок, які містяться в даній порції речовини
– Кількість речовини позначається літерою «υ» – (ню) (n)
– Моль – одиниця кількості речовини.
– Моль містить стільки структурних частинок речовини (атомів, молекул, йонів), скільки
атомів міститься в 12г вуглецю.
– Число Авогадро дорівнює 6,02· 10²³ атомів, молекул або інших структурних
частинок.
Рефлексія.
– Що нового дізналися на уроці?
– Що виявилося складним?
– Що вимагає додаткового обговорення?
VI. Домашнє
завдання
Опрацювати
відповідний параграф підручника, відповісти на питання.


Немає коментарів:
Дописати коментар